一、总体要求
1. 伦理委员会接待时间:每周一至周四:上午10:00-11:30,下午15:00-16:30。
2. 伦理委员会办公室地址:襄阳市中心医院东津院区门诊4楼9区4902。
3. 伦理委员会联系电话:0710-3511354。
4. 伦理审查费支付账号:
账户名称:襄阳市中心医院
开户行:工行襄阳荆州街支行
账号:1804 0011 2904 4004 092
伦理审查费缴纳范围:会议审查、年度跟踪审查。
伦理审查费缴纳时限:审查前3天,且需于每月1-25号打款,不允许月底打款。打款后自行填写并发送收款通知书(附件1)至伦理群。
发票需于通知后的10个工作日内领取,逾期不予办理。
5. 以下所有涉及的模板均参照:https://xyszxyy.wetrial.com/-下载中心-伦理流程及表格。
6. 批件领取注意事项:
1)领取批件后,请将扫描版发送至伦理邮箱xyszxyyll01@163.com,批件命名为:批复日期-申办方-方案编号-审查类别,主题命名为:申办方-方案编号-初始审查/跟踪审查批件。
2)批件请于通知后的10个工作日内领取,逾期将不予办理。
二、初始审查
1. 伦理会议时间安排详见伦理委员会会议审查时间安排表,原则上,伦理会召开频率为每两周一次,若遇到节假日或特殊情况,伦理会时间将在伦理群另行通知。
2. 接机构立项完成通知后,发送伦理材料(伦理清单参照立项清单)至伦理邮箱xyszxyyll01@163.com进行形式审查,以收到邮件时间为准,上会前7天发送伦理材料的项目可排本轮伦理会,其余则顺延至下轮伦理会。电子版资料要求:需要研究者签字的文件需上传签字后扫描件,其余电子文件以盖章后的PDF格式为准。初始审查前3天将伦理审查纸质版资料1份交至伦理委员会办公室:襄阳市中心医院东津院区门诊4楼9区4902。
3. 简版材料要求如下:
药物临床试验伦理简版资料清单要求:
1) NMPA 临床试验批件或药品注册批件;
2) 组长单位伦理委员会批件;
3) 研究者资质文件;
4) 试验研究方案(注明版本号/版本日期);
5) 知情同意书(注明版本号/版本日期)和其他提供给受试者的书面材料;
6) 受试者招募的方式和信息;
7) 现有的安全性资料;
8) 包含受试者补偿信息的其他文件;
9) 临床试验保险。
医疗器械临床试验伦理简版资料清单要求:
1) 国家药品监督管理局医疗器械临床试验批件(适用于列入需进行临床试验审批的第三类医疗器械目录的医疗器械);
2) 组长单位伦理委员会批件(如适用);
3) 研究者资质文件;
4) 试验研究方案(注明版本号/版本日期);
5) 知情同意书(注明版本号/版本日期)和其他提供给受试者的书面材料;
6) 受试者招募的方式和信息;
7) 现有的安全性资料;
8) 医疗器械自检报告和产品注册检测报告;
9) 试验用医疗器械的研制符合适用的医疗器械质量管理体系相关要求的声明;
10) 临床试验保险。
简版材料格式要求:
1)文件需装入文件夹或拉杆夹;
2)要求有封面、目录、页码;
3)各文件需要隔页分开。
3. 伦理审查意见常见问题:
1)涉及到伦理前置审查的研究请按以下流程(《前置伦理审查资料一致性声明》见附件2):
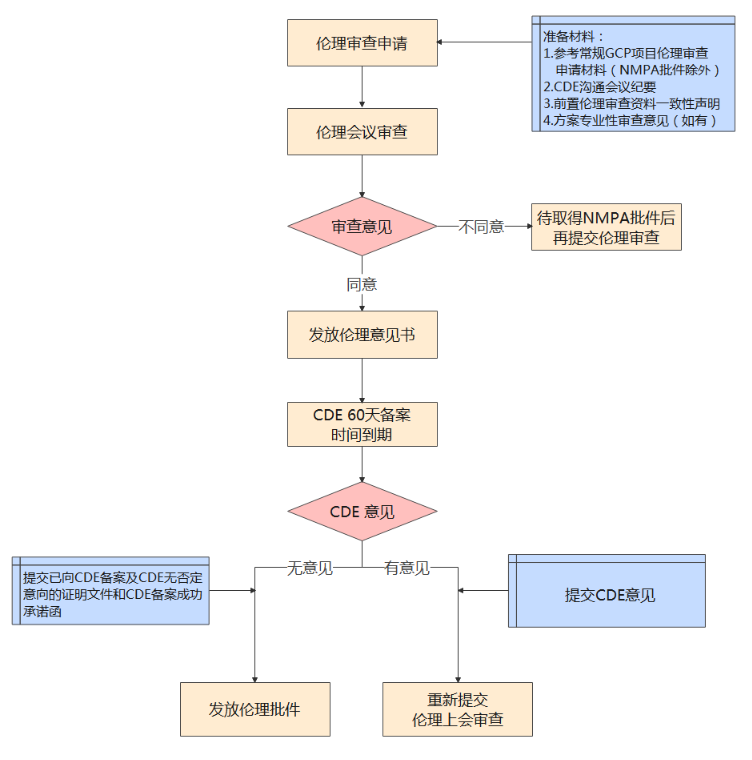
★★知情相关:
1)我院伦理委员会全称为:襄阳市中心医院药物(器械)临床试验伦理委员会,联系电话:0710-3511354,联系地址:襄阳市东津新区鹿门大道5号襄阳市中心医院东津院区。
2)根据《药物临床试验质量管理规范》(2020年)第二章第九条关于受试者的定义,核查全文,将限定参与临床研究的“患者”称谓根据文中的情景内容替换为“受试者”或“您”等称谓。
3)关于受试者补偿:采血补偿、访视交通补偿及肿瘤组织活检营养补贴等不能归类为报酬;PK、CTC、免疫原性、生物标志物检测等采血营养补偿不低于200元/采血点,访视交通补偿:每次访视不低于200元,交通补偿建议不分市内、市外,统一补贴标准;需要重新采集活检肿瘤组织标本补偿、采集脑脊液标本补偿金额不低于500元/次。
4)研究相关损害的补偿与赔偿,根据2020年版《药物临床试验质量管理规范》第三十九条:申办者应当承担受试者与临床试验相关的损害或者死亡的诊疗费用,以及相应的补偿。申办者和研究者应当及时兑付给予受试者的补偿或者赔偿。研究者和申办方的赔偿责任可通过合同规定,知情中受试者只需要被告知何种情况可以得到赔偿。注意:不要有“医疗事故除外”等表述,若有,建议删除。医疗事故是在行政管理和处罚中使用的,司法系统现在统一使用医疗损害责任纠纷。
5)采血点及采血量应在知情同意书中说明。
6)英文缩写首次出现应有中文标注。
7)签名页中:对于无民事行为能力或部分民事行为能力的受试者,需监护人签字。
8)不能将免费用药作为获益内容。
9)涉及患者隐私提供给第三方(向人类遗传资源办公室提出申请标本外送时、保险赔偿流程执行时),需要补充操作流程、保密声明等资料供伦理审查。
10)受试者的血液及组织标本均需外送,需要提供外送检测单位的资质证明及保密协议。知情同意书中需告知外送哪家实验室进行检测,检测后样本的处理。
11)避免出现“撤回知情同意书”,可以用“退出研究”代替。
12)知情同意书需通俗易懂,特别对于国外翻译译本,应加以润色,避免因此再次上会。
★★主要研究者资质材料相关:
1)主要研究者资质文件:相关GCP证书请附上最新版,可联系相关专业秘书或机构办秘书王老师(联系电话:0710-2811523)获取。
★★PPT要求:
1)使用我院统一模板;
2)内容与递交的伦理材料保持一致,同步、及时更新。
★★其他:
1)伦理审核材料要求提供全部组长单位批件,包括审核未通过的相关意见。
2)涉及其他科室的试验,研究团队中需有一名该相关医学背景医生。如涉及中医的试验,研究团队中需有一名中医背景医生。
6. 伦理会决定传达:
1)同意:出《伦理批件》,伦理会后请准备电子版《伦理会议记录》、《药物临床试验伦理委员会会议审查批件》、会议照片、会议录音打包发送至伦理邮箱xyszxyyll01@163.com。
2)作必要修正后同意:出《伦理审查意见》,伦理会后请准备电子版《伦理会议记录》、《伦理审查意见》、会议照片、会议录音打包发送至伦理邮箱xyszxyyll01@163.com,根据伦理意见对项目进行修正及说明,进入复审审查程序(具体流程见“四、复审审查”)。
三、修正案审查
1. 修正案审查范围:研究方案、知情同意书、招募广告、保险、以及其他提供给受试者的书面资料的修改,应经过伦理委员会同意后执行。除非研究方案的修改仅涉及研究管理等方面,如更换监察员、变更电话号码、变更药品批号。
2. 递交电子版资料,包括递交信、《研究方案修正申请表》(1 份)、《修正案审查工作表》(2 份)、《快速审查批件》(1 份)及修正材料,发送至伦理邮箱xyszxyyll01@163.com进行形式审查。电子版资料要求:需要研究者签字的文件需上传签字后扫描件,其余电子文件以盖章后的PDF格式为准。
3. 电子资料形式审查通过后,递交伦理审查纸质版资料。
4. 轻微方案修正采用快速审查流程,重大方案修正采用会议审查流程。如为快速审查,无需缴纳伦理审查费;如需会议审查,需缴纳伦理审查费5300元含税,流程同初始审查。
5. 材料形式审查常见问题:
1)有版本号、版本日期的文件务必确保与清单中所列的版本号/日期保持一致。
2)如有组长单位批件,需提交。
3)修正情况一览表要求如下:(1)要素包括修正材料名称和具体页码、修正前内容、修正后内容、修正原因、是否有实质性变更、对受试者安全和研究实施的潜在影响;(2)修改对比文件中需体现修改痕迹,删除的内容用删除线标注或特殊颜色标注,增加的内容用下划线标注或特殊颜色标注。
6. 伦理审查意见常见问题参照“二、初始审查 第4条”进行自查。
四、复审审查
1. 根据伦理意见修正后复审或申请者提出反馈意见进行复审:如为快速审查,无需缴纳伦理审查费;如需会议审查,需缴纳伦理审查费5300元(含税),流程同初始审查。
2. 递交电子版资料,包括递交信、《复审申请表》(1 份)、《复审工作表》(2 份)、《快速审查批件》(1 份),批件复审资料清单(含版本号)和复审资料,发送至伦理邮箱xyszxyyll01@163.com进行形式审查。电子版资料要求:需要研究者签字的文件需上传签字后扫描件,其余电子文件以盖章后的PDF格式为准。
3. 电子资料形式审查通过后,递交伦理审查纸质版资料。
4. 材料形式审查常见问题:
1)需提供修正的对比清单和修正后的内容及相关资料,有版本号、版本日期的文件务必确保与清单中所列的版本号/日期保持一致。
2)修正情况一览表要求如下:(1)要素包括修正材料名称和具体页码、修正前内容、修正后内容、修正原因;(2)修改对比文件中需体现修改痕迹,删除的内容用删除线标注或特殊颜色标注,增加的内容用下划线标注或特殊颜色标注。
3)复审审查时需对伦理委员会的意见逐条回复并/或提交修改后文件,如伦理意见不涉及的文件,无需再次递交,例如仅对知情同意书提出伦理修改意见,未对研究方案提出伦理修改意见,则无需再提交研究方案。
五、年度/定期跟踪审查(持续审查)
1. 请在截止日期前一个月递交伦理审查电子版资料,包括递交信、《研究进展报告》(1 份)、《年度定期跟踪审查工作表》(2 份)、《快速审查批件》(1 份),发送至伦理邮箱xyszxyyll01@163.com进行形式审查。
2. 形式审查通过后,递交纸质版资料。
3. 伦理审查费1060元含税(递交纸质版材料前完成打款,否则不予受理)。
4. 形式审查常见问题:
1)递交的资料需与审查文件清单所列保持一致。
2)“年度/定期跟踪审查申请表”中“伦理审查批件有效期”填写注意要点:每次年度/定期跟踪审查报告的起止时间要连续。
六、暂停/终止审查
1. 递交电子版资料,包括《暂停终止研究报告》(1份)、《暂停/终止临床研究审查工作表》(2份)、《伦理审查意见》(1份),发送至伦理邮箱xyszxyyll01@163.com进行形式审查。
2. 形式审查通过后,递交纸质版资料。
七、结题审查
1. 完成伦理材料归档。归档要求:材料整理好后用档案盒归档,侧签除要求的项目基本信息外,另需加上项目的结题时间。
2. 递交电子版资料,包括《研究完成报告》(1份)、临床试验结果的摘要、《研究完成审查工作表》(2份)、《伦理审查意见》(1份),发送至伦理邮箱xyszxyyll01@163.com进行形式审查。
3. 电子资料形式审查通过后,递交伦理审查纸质版资料。
八、安全性审查
(一)药物临床试验中发生的本院个例SUSAR、致死或危及生命的SAE;医疗器械临床试验中发生的所有SAE
1. 递交电子版资料,包括递交信、《严重不良事件报告表》。电子版资料要求:研究者签字的文件需上传签字后扫描件,发送至伦理邮箱xyszxyysusar@163.com,邮箱需附上联系方式。
2. 递交纸质版资料,纸质版资料要求为研究者签字的文件及SAE/SUSAR报告。
3. 递交时限:
3.1 本院个例SUSAR
1)申办方应当遵循7天和15天的快速报告要求,首先在规定时限内将电子版资料发送至邮箱(邮箱地址:xyszxyysusar@163.com 邮件主题:本院SUSAR/SAE+不良事件名称+申办方名称+方案编号)。
2)快速报告后于5个工作日内将纸质版材料递交至伦理办公室。
3.2 致死的SAE(药物类临床试验)
1)研究者需在获知后24小时内上报至我院伦理委员会。
2)审查材料:SAE报告、科内死亡讨论、尸检报告和最终医学报告。
3)审查方式:一般选择会议审查,除非有明确证据证明与研究肯定无关,可选择快速审查。
3.3 本院SAE(医疗器械类临床试验)
1)研究者应当在获知严重不良事件后24小时内,向伦理委员会报告;并按照临床试验方案的规定随访严重不良事件,提交严重不良事件随访报告。
2)审查材料:SAE报告、
(二)外院SUSAR
1. 递交时限:每3个月汇总1次,汇总内容:3个月的SUSAR个例报告,3个月的所有SUSAR行列表汇总,以及分析报告。
2. 材料要求:(1)SUSAR行列表汇总需要按照SUSAR发生的时间先后顺序排序。(2)分析报告需要分析同一类型SUSAR的发生例数、发生率,与试验药物的相关性,以及针对发生率较高的SUSAR制定的风险预案,分析是否需要同步修改方案和知情同意书。
3. 递交方式:线下递交至伦理办公室。
纸质版资料:递交信(注明方案编号+本次汇总个例SUSAR报告的时间段),季度SUSAR行列表汇总和分析报告。
刻盘:季度SUSAR个例报告。
(三)发现医疗器械临床试验的风险超过可能的受益,需要暂停或者终止临床试验时,主要研究者应当向伦理委员会报告,及时通知受试者,并保证受试者得到适当治疗和随访。
九、违背方案审查
1. 递交电子版资料,发送至伦理邮箱xyszxyyll01@163.com进行形式审查:
1)轻度方案违背:每1-3个月汇总报告,采用备案流程,递交材料包括递交信、《违背方案报告》;
2)重度方案违背:发现后及时递交,一般选择快速审查流程,递交材料包括递交信、《违背方案报告》、《违背方案审查工作表》(2份)、《快速审查批件》(1 份)。若发生对受试者风险显著增加的方案违背事件,需进行会议审查流程。
2. 电子资料形式审查通过后,递交伦理审查纸质版资料。
3. 形式审查常见问题:
1)《违背方案报告》填写要求:分析违背原因,以及制定整改措施,同时分析对受试者权益和安全的可能影响,或者对临床试验的科学性、完整性的可能影响。
2)整改措施附上相关记录,如培训需附上培训记录、签到表、照片等。
十、普通备案资料
1. 文件清单需与递交材料的内容、顺序保持一致。
2. 递交信体现递交文件清单,要求清单准确无误且和实际材料一致,递交信不要出现手改内容。伦理递交信回执上必须体现伦理签收类型,如下:
我伦理委员会确认已收到上述文件,并将:
¨择时举行会议进行审批,之后会给予书面回复;
¨进行快速审批,之后给予书面回复;
¨接受这些资料在本中心进行备案。
签名: 日期:
十一、格式要求
1. 伦理审查材料中审查要素的勾选要求用黑笔手动打勾þ。
2. 如一份递交信中所包含的全部材料超过30张纸,请刻光盘递交,纸质版材料需要保留盖章页和签字页。
附件1:
收款通知书
财务处:
汇款单位名称于xxxx年xx月xx日汇入我院的一笔款项,金额为xxxx元(包含6%税费),此款系“项目名称”伦理初审/年度跟踪审查费,请将该笔款项计入GCP伦理审查费专账,并予以开增值税专用/普通(二选一)发票。
发票信息 | |
名称 | |
纳税人识别号 | |
地址、电话 | |
开户行 | |
账号 | |
经办人: 经办人手机号:
襄阳市中心医院药物(器械)临床试验伦理委员会
xxxx年xx月xx日
附件2
前置伦理审查资料一致性声明
兹郑重声明,我单位申请在贵院开展的项目:
属于:□国际多中心临床试验项目 □一类新药临床试验项目。
该项目已于XX年X月X日在国家药品监督管理局药品审评中心(CDE)举行沟通会,并按照CDE会议纪要确定试验方案(版本号及版本日期)等相关资料。我们保证提交给贵院的所有资料与提交至CDE的完全一致。
若违反上述声明,将承担全部责任。
特此声明。
XXX公司(盖章)
负责人签名:
日期:



